অ্যাসাইনমেন্ট
শিরোনাম: ‘যৌগ গঠনর সময অষ্টক নিয়ম ও দুই- এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া,
পানিতে দ্রব্যতা এবং বিদ্যুৎ পরিবাহিতা"
প্রতিবেদনের
তারিখঃ ০৭-০৯-২০২১
বরাবর,
প্রধান
শিক্ষক
বি,পি উচ্চ বিদ্যালয়
উখিয়া, কক্সবাজার।
বিষয়ঃ
যৌগ গঠনের সময় অষ্টক নিয়ম ও দুই- এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে দ্রাব্যতা
এবং বিদ্যুৎ পরিবাহিতা বিষয়ক প্রতিবেদন।
জনাব,
বিনীত
নিবেদন এই যে, আপনার আদেশ নং জি.এম.উ.বি. ২৫৬-৮ তারিখঃ ০৬-০৯-২০২১ অনুসারে “যৌগ গঠনের
সময় অষ্টক নিয়ম ও দুই- এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে দ্রাব্যতা এবং
বিদ্যুৎ পরিবাহিতা" শীর্ষক প্রতিবেদন নিয়ে পেশ করা হলো।
যৌগ গঠনের সময় অষ্টক নিয়ম ও দুই- এর নিয়ম অনুসরণ, এদের গঠন প্রক্রিয়া, পানিতে দ্রাব্যতা এবং বিদ্যুৎ পরিবাহিতা”
ক) অষ্টক ও দুই- এর নিয়মঃ
অষ্টক
নিয়মঃ অনু গঠনকালে কোন মৌল ইলেকট্রন গ্রহণ, বর্জন অথবা ভাগাভাগির মাধ্যমে তার সর্বশেষ
শক্তিস্তরে ৪ টি করে ইলেকট্রন ধারনের মাধ্যমে নিষ্ক্রিয় গ্যাসের ইলেকট্রন বিন্যাস লাভ
করলে, তাকে অষ্টক নিয়ম বলে।
দুই-
এর নিয়মঃ অণু গঠনকালে কোন পরমাণুর সর্বশেষ শক্তিস্তরে এক বা একাধিক জোড়া ইলেকট্রন
বিদ্যমান থাকলে তাকে দুই- এর নিযম বলে। উদ্দীপকে যৌগ দুটি যথাক্রমে CH4
এবং NaCI2 যৌগ দুটিতে অষ্টক ও দুই- এর নিয়ম চিত্রসহ ব্যাখ্যা করা হলো-
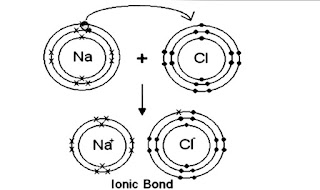
NaCl
এর রাসায়নিক গঠন এবং অষ্টক ও দুই - এর নিয়ম ব্যাখ্যাঃ
উক্ত
NaCl এর ডায়াগ্রামে Na ও c এর ইলেকট্রন বিন্যাস লক্ষ্য করলে দেখা যায় যে, Na এর সর্বশেষ
কক্ষপথ থেকে 1 টি ইলেকট্রন ত্যাগ করে অষ্টক নিয়ম পালন করেছে। অর্থাৎ ইলেকট্রন ত্যাগ
করার ফলে এখন Na এর সর্বশেষ কক্ষপথে ৪ টি ইলেকট্রন বিদ্যমান। অপরদিকে Cl তার সর্বশেষ
কক্ষপথে 1 টি ইলেকট্রন গ্রহণ করে সর্বশেষ কক্ষপথে ৪ টি ইলেকট্রন পূর্ণ করে অষ্টক নিয়ম
পালন করে। এদের মধ্যে কেউ দুই- এর নিয়ম পালন করে না।
আবার,
CH4 এর রাসায়নিক গঠন এবং অষ্টক ও দুই এর নিয়ম ব্যাখাঃ
উক্ত
CH, এর ডায়াগ্রামে C ও H এর ইলেকট্রন বিন্যাস লক্ষ্য করলে দেখা যায় যে, C এর সর্বশেষ
কক্ষ পথে 1 টি করে মোট 4 টি ইলেকট্রন শেয়ার করে অষ্টক নিয়ম পালন করেছে। অর্থাৎ ইলেকট্রন
শেয়ার করার মাধ্যমে এখন C এর সর্বশেষ কক্ষপথে ৪ টি ইলেকট্রন বিদ্যমান। অপরদিকে H তার
সর্বশেষ কক্ষপথে 1টি ইলেকট্রন শেয়ার করে সর্বশেষ কক্ষপথে 2 টি ইলেকট্রন পূর্ণ করে
দুই- এর নিয়ম পালন করে।
খ) সমযোজী বন্ধন গঠন ও দ্রবণীয়তাঃ
সমযোজী
বন্ধনঃ সমযোজী বন্ধন হল এমন এক ধরনের রাসায়নিক বন্ধন যেখালে পরমাণুসমূহ তাদের নিজেদের
মধ্যে ইলেকট্রন শেয়ারের মাধ্যমে আবদ্ধ থাকে। ইলেকট্রন শেয়ার করা পরমাণুদ্বয়ের মধ্যেকার
আকর্ষণ ও বিকর্ষণের ফলে যে সুস্থিত ভারসাম্য বল তৈরি হয় তাই সমযোজী বন্ধন।
উদ্দীপকে
CH4 যৌগটিতে সমযোজী বন্ধন গঠন ও দ্রবণীয়তা নিচে চিত্রসহ ব্যাখ্যা করা
হলোঃ
CH4:
যৌগের বিদ্যমান মৌল দুটি হল যথাক্রমে কার্বন (C) ও হাইড্রোজেন (H)। এদের ইলেকট্রন বিন্যাস
হলোঃ
C(6)=
1s22s 2p2
H(1)=
1s1
ইলেকট্রন
বিন্যাস হতে দেখা যায়, C এর শেষ কক্ষপথে 4 টি ইলেকট্রন এবং হাইড্রোজেনের শেষ কক্ষপথে
1 টি ইলেকট্রন বিদ্যমান। ফলে শেষ শক্তিস্তরে অষ্টক পূরণের জন্য কার্বনের আরো ৪টি ইলেকট্রন
প্রয়োজন। তাই প্রতিটি কার্বন 4 টি হাইড্রোজেন পরমাণুর সাথে ৭ টি ইলেকট্রন শেয়ার
করে নিয়নের (Ne) ইলেকট্রন বিন্যাস অর্জন করে। অপরদিকে প্রতিটি হাইড্রোজেন কার্বনের
একটি করে ইলেকট্রন শেয়ার করে হিলিয়ামের (He) ইলেকট্রন বিন্যাস অর্জন করে। এভাবে ইলেক্ট্রন
শেয়ারের মাধ্যমে C এবং H পরমাণু CH4 সমযোজী যৌগ গঠন করে।
CH4
এর পানিতে দুবণীয়তা:
যে
সকল যৌগের মেরু অর্থাৎ ধনামক ও ঋণায়ক প্রান্ত থাকেনা তাদেরকে অপোলার যৌগ বলে। CH4
একটি আপোলার এবং সমযোজী। অন্যদিকে আমরা জানি যে অধিকাংশ আয়নিক যৌগ এবং পোলার সময়
যৌগ সমূহ পানিতে দ্রবীভূত হয়। যেহেতু CH4 একটি আপোলার এবং সমযোজী যৌগ
তাই CH4 গ্যাসকে পানিতে দ্রবীভূত করলে পানির আংশিক ধনাত্নক (H+)
ও আংশিক ঋণাত্নক আয়ন (O2-) কর্তৃক আকর্ষিত হয় না। তাই CH4
পানিতে | দ্রবীভূত হয় না।
(গ) আয়নিক বন্ধন গঠন ও দ্রবণীয়তাঃ
আয়নিক বন্ধ: ধাতব ও অধাতব মৌলের রাসায়নিক বিক্রিয়াকালে ধাতুর পরমানুর বহিঃস্তুর হতে অধাতু পরমানুর বহিঃস্তরে এক বা একাধিক ইলেকট্রন স্থানান্তরিত হওয়ার মাধ্যমে দৃষ্টি ধনাত্বক আয়ন ও ঋণাত্মক আয়নের মধ্যে স্থির বৈদ্যুতিক আকর্ষণ বল দ্বারা যে বন্ধন গঠিত হয় তাকে আয়নিক বন্ধন বা তড়িৎযোজী বন্ধন বলে।
উদ্দীপকের
NaCl যৌগটির আয়নিক বন্ধন গঠন ও দ্রবণীয়তা নিচে চিত্রসহ ব্যাখ্যা করা হলোঃ
Na
এর ইলেকট্রন বিন্যাস 2, 8, 11 এর সর্বশেষ শক্তিস্তরে টি ইলেকট্রন রয়েছে। Na গরমাণু
একটি ইলেকট্রন ত্যাগ করে তার নিকটতম নিষ্ক্রিয় গ্যাস Ne (10 ) এর ইলেকট্রন বিন্যাস
লাভ কার Na+ ধনাত্মক আয়নে পরিণত হয়।
আবার,
Cl (ক্লোরিন) এর ইলেকট্রন বিন্যাস 2, 8, 7। এর ইলেকট্রন বিন্যাসে সর্বশেষ শক্তিস্তরে
7টি ইলেকট্রন রয়েছে। Cl পরমাণু একটি ইলেকট্রন গ্রহণ করে তার নিকটতম নিষ্ক্রিয় গ্যাস
Ar (আর্গন) এর ইলেকট্রন বিন্যাস লাভ করে Cl- আয়নে পরিণত হয়। তাই Na একটি
ইলেকট্রন ত্যাগ করে এবং Cl একটি ইলেকট্রন গ্রহণ করে পরস্পরের মাঝে আয়নিক বন্ধন সম্পন্ন
করে স্থিতিশীলতা অর্জন করে।
NaCl
এর পানিতে দ্রবণীয়তাঃ
উদ্দীপকে NaCl যৌগটি একটি আয়নীক যৌগ যার মধ্যে ধনাত্মক Na+ ও ঋণাত্মক Cl-
প্রান্ত বিদ্যমান। পানি সমযোজী যৌগ হলেও এর মধ্যে ধনাত্মক H+ ও ঋণায়ক
OH+ প্রান্ত বিদ্যমান। NaC লবণ কে পানিতে দিলে এটি পানির অনুর সাথে আকর্ষিত
হয়। পানির ঋণাত্মক প্রান্ত NaCl এর ধনাত্মক Na+ প্রান্তকে এবং পানি ধনাত্মক
প্রান্ত NaCl এর ঋণাত্মক Cl- প্রান্তকে আকর্ষণ করার মাধ্যমে পানিতে দ্রবীভূত
করে।
 |
| চিত্রঃ Nacl- এর পানিতে দ্রবণীয়তা |
(ঘ) যৌগের বিদ্যুৎ পরিবাহিতা
বিদ্যুৎ
পরিবাহিতাঃ আমরা জানি, বিদ্যুৎপ্রবাহ মূলত ইলেকট্রনের প্রবাহকে বুঝায় যদি মুক্ত ইলেকট্রন
বিদ্যমান থাকে কোন যৌগে তাহলে বিদ্যুৎ প্রবাহিত হবে। আর যদি মুক্ত ইলেকট্রন না থাকে
তাহলে বিদ্যুৎ পরিবাহিত হবে না।
আমরা
জানি, আয়নিক যৌগ গলিত অবস্থায় বিদ্যুৎ পরিবহন করে কেননা সেখানে মুক্ত ইলেকট্রন থাকে,
কিন্তু অপোলার সমযোজী যৌগ বিদ্যুৎ পরিবহন করে না।
উদ্দীপকের
NaCl হল আয়নিক যৌগ। তাই এটিকে যদি পানিতে দ্রবীভূত করা হয় তাহলে পানিতে অসংখ্য মুক্ত
ইলেকট্রন থাকবে। ফলে সেই পানিতে বিদ্যুৎ পরিবহন হবে।
চিত্রের
মাধ্যমে উপস্থাপন করা হলোঃ
 |
| চিত্রঃ পানিতে মুক্ত Cl এর ঋনাত্বক আয়ন শানাক্তকরণ |
যেহেতু
পানিতে অসংখ্য Cl- এর মুক্ত ইলেকট্রন বিদ্যমান। সুতরাং সোডিয়াম ক্লোরাইড
কে পানিতে দ্রবীভূত করলে তা বিদ্যুৎ পরিবহন করবে।
উদ্দীপকের
CH4 হলো সমযোজী যৌগ এবং অপোলার যৌগ। আর অপোলার সমযোজী যৌগের কোন ধনাত্মক
ও ঋনাত্মক প্রান্ত থাকেনা। যেহেতু CH4 অনু অপোলার এবং সমযোজী তাই CH4
বিদ্যুৎ পরিবহন করবে না।
প্রতিবেদকের
নাম ও ঠিকানাঃ
নামঃ
তুষমি বড়ুয়া
১০ম
শ্রেণি, রোল: ১০
বিভাগ:
বিজ্ঞান
প্রতিবেদনের
সময়ঃ সকাল ১০ টা,
প্রতিবেদনের
তারিখঃ ০৭-০১-২০২১














Post a Comment
0 Comments